PD-1/PD-L1免疫疗法是当前备受全世界瞩目、正掀起肿瘤治疗的革命,引领癌症治疗的变革,为患者带来新的希望的新一类抗癌免疫疗法,旨在充分利用人体自身的免疫系统抵御、抗击癌症,通过阻断PD-1/PD-L1信号通路使癌细胞死亡,具有治疗多种类型肿瘤的潜力,实质性改善患者总生存期。
与传统疗法相比,免疫疗法最大的优势之一,就是疗效具有持久性。比如,在黑色素瘤里,欧美20%左右的晚期患者能实现临床治愈,成为“超级幸存者”,这是免疫疗法带来的生命奇迹。
全球肿瘤专家对免疫药物感到无比兴奋,有几个最大的原因:
1:它有更广谱的抗癌效果(O药已经在全球获批治疗9个癌种,k药获批9个癌种)。
2:它比化疗的整体副作用要小得多。
3:它如果起效,可能让晚期患者长期存活,甚至临床治愈,这是免疫药物区别于其它所有药物最大的不同。
PD-1/PD-L1
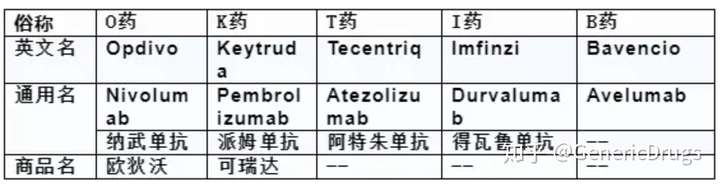
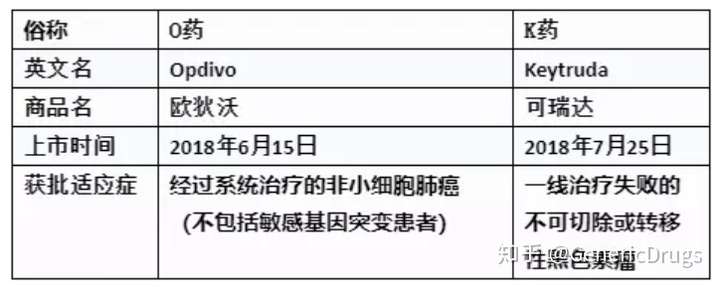
目前,全球上市的免疫检查点抑制剂PD-1或PD-L1抑制剂共5个,
O药:Opdivo(Nivolumab)、
K药:Keytruda(Pembrolizumab)、
T药:Tecentriq(Atezolizumab)、
I药:Imfinzi(Durvalumab)、
B药:Bavencio(Avelumab)。
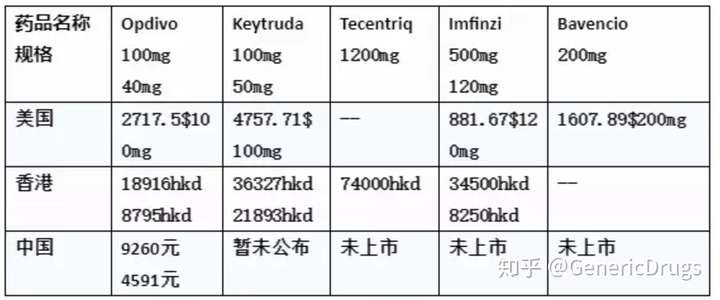
近两日让癌友圈振奋的好消息是O药和K药都以正式运抵中国,并且O药在国内的价格也已全面公布,中国的患者终于迎来了真正的免疫治疗元年!GenericDrugs现将药物用药信息总结如下,供癌症患者参考。
药品名称
生产商

作用靶点

适应症
首次获批时间

使用周期

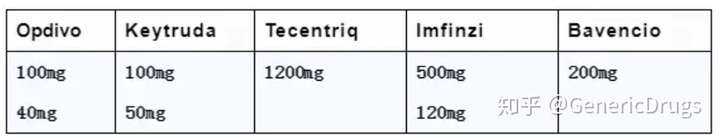
使用剂量

剂型规格
全球比价
国内上市情况
K药、O药、T药、B药、I药,免疫药物PD-1治疗药物如何选择?
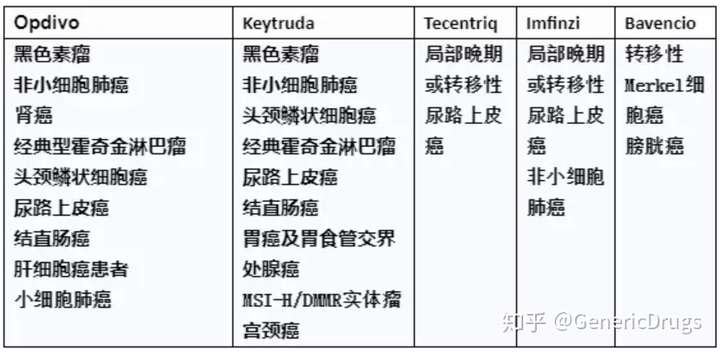
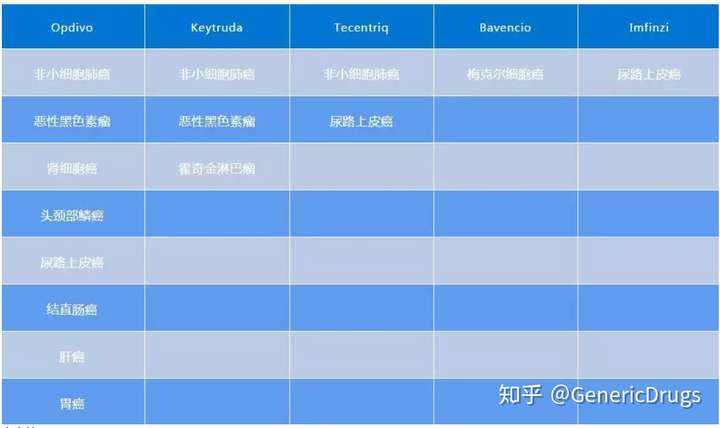
一、Keytruda(Pembrolizumab)
1. 黑色素瘤。累及淋巴结的黑色素瘤完全切除后的辅助治疗;转移性或不可切除的黑色素瘤。
2. 非小细胞肺癌(NSCLC)。(1)与培美曲塞和含铂类药联用于不伴 EGFR 或 ALK 基因突变的转移性非鳞状 NSCLC 的一线治疗;(2)与卡铂和紫杉醇联用于转移性鳞状 NSCLC 的一线治疗;(3)不适合手术切除或根治性放化疗的/转移性的表达程序性死亡蛋白配体-1(PD-L1)[肿瘤比例评分(TPS)≥ 1%] 且不伴表皮生长因子(EGFR)或间变性淋巴瘤激酶(ALK)基因突变的 III 期 NSCLC 的一线治疗;(4)先前使用含铂类药化疗时或化疗后疾病进展且肿瘤表达 PD-L1(TPS ≥ 1%) 的转移性 NSCLC(伴 EGFR 或 ALK 基因突变的患者在接受靶向治疗出现疾病进展后方可使用本药)。
3. 小细胞肺癌(SCLC)。既往接受含铂类化疗方案和至少一种其他化疗方案治疗后疾病进展的转移性 SCLC。
4. 头颈部鳞状细胞癌(HNSCC)。(1)与铂类和氟尿嘧啶联合一线治疗转移性/不可切除/复发的 HNSCC;(2)单药一线治疗表达 PD-L1[联合阳性评分(CPS)≥ 1] 的转移性/不可切除/复发的 HNSCC;(3)先前使用含铂类药化疗时或化疗后疾病进展 HNSCC。
5. 经典霍奇金淋巴瘤(cHL)。难治性 cHL 或先前使用 3 种/3 种以上方案治疗后复发的 cHL。
6. 原发性纵膈大 B 细胞淋巴瘤(PMBCL)。难治性 PMBCL 或先前使用 2 种或 2 种以上方案治疗后复发的 PMBCL 成人和儿童患者。不推荐用于需紧急细胞减灭治疗的患者。
7 尿路上皮癌(UC)。不适合含顺铂化疗方案且肿瘤表达 PD-L1[联合阳性评分(CPS)≥ 10] 或不适合含铂类药化疗(不考虑 PD-L1 状态)的局部晚期或转移性 UC;先前使用含铂类药化疗时或化疗后疾病进展的局部晚期或转移性 UC;使用含铂类药化疗的新辅助或辅助治疗 12 个月内疾病进展的局部晚期或转移性 UC;无法切除/转移性微卫星高不稳定性(MSI-H)癌或错配修复基因缺陷肿瘤。
9. 胃癌。既往使用 2 种或 2 种以上方案 [包括氟尿嘧啶、铂类化疗药和 HER2 靶向治疗] 化疗时或化疗后疾病进展的肿瘤表达 PD-L1(CPS ≥ 1)的局部晚期复发性或转移性胃癌或胃食管交界处腺癌。
10. 食管癌。肿瘤表达 PD-L1(CPS ≥ 1)、既往经 1 种或多种方案全身治疗后疾病进展的复发性局部晚期或转移性食管鳞状细胞癌。
11. 宫颈癌。化疗时或化疗后疾病进展的肿瘤表达 PD-L1(CPS ≥ 1)的复发性或转移性宫颈癌。
12. 肝细胞癌。先前使用索拉非尼治疗的肝细胞癌。
13. Merkel 细胞癌。局部晚期复发性或转移性 Merkel 细胞癌。
14. 晚期肾细胞癌。与阿昔替尼联用于晚期肾细胞癌的一线治疗。
二、Opdivo(Nivolumab)
1. 黑色素瘤:单用于 BRAF V600 野生型或突变阳性的无法切除的或转移性黑色素瘤;与易普利单抗联用于无法切除的或转移性黑色素瘤;经淋巴结或转移性疾病完全切除的黑色素瘤的辅助治疗。
2. 非小细胞肺癌(NSCLC)。铂类化疗期间或化疗后进展的转移性 NSCLC(伴 EGFR 或 ALK 基因突变的患者在接受靶向治疗出现疾病进展后方可使用本药)。
3. 小细胞肺癌(SCLC)。既往接受含铂类化疗方案和至少一种其他化疗方案治疗后疾病进展的转移性 SCLC。
4. 肾细胞癌(RCC)。既往接受过抗血管生成疗法的晚期 RCC;与易普利单抗联用联用于既往未接受过治疗的中低风险 RCC。
5. 经典型霍奇金淋巴瘤(cHL)。经自体造血干细胞移植(HSCT)和贝伦妥单抗-维多汀治疗后或包括自体 HSCT 在内的 3 种或 3 种以上系统疗法治疗后复发/进展的 cHL 成人患者。
6. 头颈部鳞状细胞癌(HNSCC)。既往接受含铂类化疗方案治疗时或治疗后疾病进展的复发性或转移性 HNSCC。
7. 尿路上皮癌(UC)。既往接受铂类化疗方案和至少一种其他化疗方案治疗后疾病进展或先前接受含铂类化疗方案新辅助治疗或辅助治疗 12 个月内疾病进展的局部晚期或转移性 UC。
8. 转移性结直肠癌(mCRC)。单用或与易普利单抗联用于既往接受氟尿嘧啶、奥沙利铂、伊立替康治疗后疾病进展的微卫星高度不稳定(MSI-H)或错配修复缺陷(dMMR)的 mCRC 成人和儿童患者(12 岁以上)。
9. 肝细胞癌(HCC)。既往接受索拉非尼治疗的 HCC。
三、Tecentriq(Atezolizumab)
1. 尿路上皮癌。治疗不适用以顺铂为基础的化疗且肿瘤表达 PD-L1(≥ 5% 的肿瘤区域存在免疫浸润细胞表达 PD-L1)的局部晚期或转移性 UC;治疗不适用任何含铂类化疗的局部晚期或转移性 UC,可不考虑 PD-L1 表达情况;既往接受铂类化疗或接受含铂类化疗方案新辅助治疗或辅助治疗 12 个月内疾病进展的局部晚期或转移性 UC。
2. 非小细胞肺癌(NSCLC)。与贝伐珠单抗、紫杉醇及卡铂联用于转移性非鳞状 NSCLC(无 EGFR 或 ALK 突变)的一线治疗;含铂类药化疗期间或化疗后疾病进展的转移性 NSCLC。有 EGFR 或 ALK 突变者需接受靶向治疗进展后方可使用本药;
3. 乳腺癌:与白蛋白结合型紫杉醇联合用于不可切除的局部晚期或转移性三阴性乳腺癌,且肿瘤细胞表达 PD-L1(≥ 1% 的肿瘤区域存在免疫浸润细胞表达 PD-L1)。
4. 小细胞肺癌(SCLC):与卡铂和依托泊苷合用于成人广泛期 SCLC 的一线治疗。
四、Bavencio(Avelumab)
1. Merkel 细胞癌(MCC)。转移性 MCC 成人或 12 岁以上儿童患者。
2. 尿路上皮癌(UC)。以顺铂为基础的化疗期间或化疗后进展局部晚期或转移性 UC;以铂类为基础的新辅助化疗或辅助化疗后 12 个月内进展的局部晚期或转移性 UC。
3. 肾细胞癌(RCC)。与阿昔替尼合用于晚期 RCC 患者的一线治疗。
五、Imfinzi(Durvalumab)
1. 尿路上皮癌(UC)。以顺铂为基础的化疗期间或化疗后进展局部晚期或转移性 UC;以铂类为基础的新辅助化疗或辅助化疗后 12 个月内进展的局部晚期或转移性 UC。
2. 非小细胞肺癌(NSCLC)。以铂类为基础的放化疗后未进展的不可切除的 III 期 NSCLC。
关于PD-1患者关心的六大问题
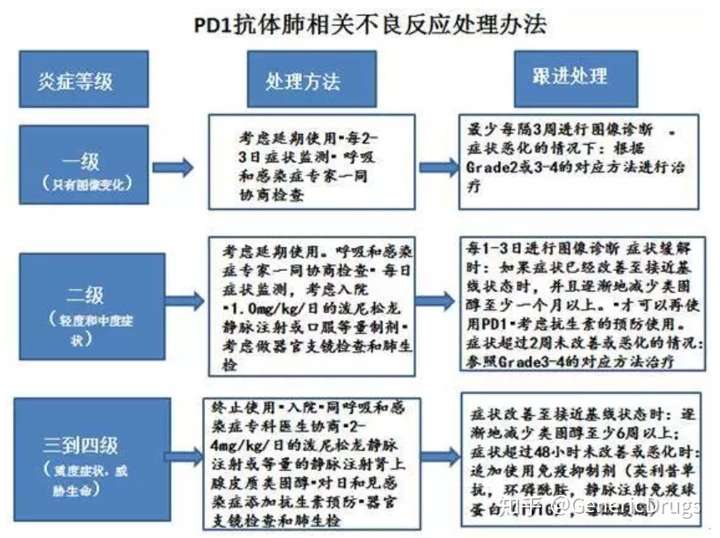
一、副作用的处理
PD-1抑制剂,总体的副作用远小于传统的放化疗。最常见的副作用是“流感”样的表现:发热、乏力、头晕、全身肌肉酸痛、嗜睡等,发生率在30%左右,对症处理即可。
肺部问题(肺炎):新发或恶化的咳嗽;胸痛;气短。
肠道问题(结肠炎):可能导致肠道内的炎症或穿孔。包括:腹泻或排便次数多于平常;便血和腹部严重(腹部)疼痛或压痛。
肝病(肝炎):皮肤或眼睛变黄;严重恶心或呕吐;腹部右侧的疼痛(腹部);嗜睡;尿黄(茶色);皮肤容易出血或瘀血;常有饥饿感。
内分泌问题(特别是甲状腺,垂体,肾上腺和胰腺):激素腺体不能正常工作,包括:持续头痛或不寻常的头痛;极度疲劳,体重增加或减少;眩晕或昏厥;情绪或行为的变化,如性行为减少,烦躁或健忘;脱发、感冒、便秘;声音改变、口渴或尿多。
肾脏问题:包括肾炎和肾衰竭。包括:尿量减少;尿液中的血液、脚踝肿胀和食欲不振。
皮肤问题:这些问题的迹象可能包括:皮疹、瘙痒、皮肤起泡和口腔或其他粘膜中的溃疡。
大脑炎症(脑炎):包括:头痛、发热、疲倦或虚弱混乱、记忆问题、嗜睡、幻觉、癫痫发作。
其他器官的问题:视力的变化;严重或持续的肌肉或关节疼痛和严重的肌肉无力。
严重的输液反应:发冷或寒战、瘙痒或皮疹、呼吸困难、头晕、发热。
使用pd-1治疗,慎用异体干细胞移植并发症。这些并发症可能很严重,可能导致死亡。
此外,大约5%-10%的患者,会出现严重的免疫相关的炎症反应:甲状腺炎症(表现为甲亢、甲减、或先甲亢后甲减)、免疫性肺炎、免疫性肠炎、免疫性肝炎、甚至免疫性心肌炎。免疫性炎症,如果发现不及时,处理不到位,偶尔发生致命的事故。
对于甲状腺问题,可以请内分泌科医生会诊。甲亢可以服用抗甲状腺药物,甲减可以补充优甲乐。
对于免疫性炎症,如肺炎、肝炎、肠炎等,需要酌情加上口服或静脉的糖皮质激素,如地塞米松、泼尼松、甲强龙等,对于病情较重的,还需要加上环磷酰胺、霉纷酸脂等免疫抑制剂。
对于发生细胞因子风暴的患者,需要及时使用IL-6抗体,托珠单抗。
二、PD-1抑制剂的疗效如何?
在绝大多数、未经挑选的实体瘤中,单独使用PD-1抑制剂的有效率,其实并不高:10%-30%左右。唯一的例外,是经典型霍奇金淋巴瘤,有效率突破60%以上。
PD-1抑制剂有效率偏低,为何学术界和癌友圈还如此疯狂和痴迷呢?主要的原因是:PD-1抑制剂疗效的持久性。由于免疫系统具有记忆功能,因此一旦PD-1抑制剂起效,其中部分病友实现临床治愈,也就是说五年、十年不复发、不进展、长期生存。尤其是较早的恶性黑色瘤、肾癌以及非小细胞肺癌中,都已经观察到了类似的现象:PD-1抑制剂的出现,将晚期恶性黑色素瘤和晚期非小细胞肺癌的生存率提高了数倍:晚期恶性黑色素瘤的5年生存率从15%左右,提高到了35%上下;而晚期非小细胞肺癌的5年生存率从5%左右,提高到了15%上下!
此外,通过联合治疗,把原来不适合PD-1抑制剂治疗的病人,转化为可以从中获益的人群也可以提高治疗效果。目前,PD-1抑制剂主流的搭档有如下几个:
(1) 联合另一个免疫治疗药物:PD-1抑制剂联合CTLA-4抗体,已经被批准用于恶性黑色素瘤;在肾癌、TMB高的非小细胞肺癌中三期临床试验已经成功。此外,IDO抑制剂、TIM-3抑制剂、LAG-3抗体等新型的免疫治疗新药,正在研发中。
(2) 联合化疗:PD-1抑制剂联合化疗,已经被批准用于晚期非鳞非小细胞肺癌一线治疗;类似的方案,用于胃癌、肠癌、三阴性乳腺癌等也有不错的初步数据。
(3) 联合放疗:PD-1抑制剂联合放疗,在肺癌、恶性黑色素瘤等肿瘤中,已有不错的数据;回顾性研究甚至提示,放疗联合PD-1抑制剂,可以将生存期提高数倍。
(4) 联合靶向药:PD-1抑制剂联合抗血管生成的靶向药(贝伐、阿西替尼、乐伐替尼、卡博替尼等),已有不错的初步数据;但联合EGFR抑制剂(如易瑞沙、特罗凯、凯美钠、阿法替尼、泰瑞沙等),需要当心,可能发生严重的副作用。
(5) 联合溶瘤病毒:PD-1抑制剂联合溶瘤病毒T-VEC,在恶性黑色素瘤中,有效率超70%,完全缓解率突破30%,非常有前景。在其他肿瘤中,多种溶瘤病毒正在研发中。
(6) 联合个性化肿瘤疫苗:基于肿瘤基因突变所产生的新生抗原(neoantigen),可以设计和合成多肽或RNA疫苗。PD-1抗体联合这类私人订制、个性化肿瘤疫苗,已经有初步的成功经验,可以预防肿瘤复发,可以初步临床治愈晚期肿瘤。
(7) 联合特异性肿瘤免疫细胞治疗:PD-1抑制剂联合CAR-T等新型的特异性肿瘤免疫细胞治疗,在血液肿瘤中,已有初步的、不俗的数据。
三、如何预测PD-1的效果?
PD-1抑制剂在未经选择的实体瘤患者中,有效率只有10%-30%;究竟哪些患者能够最终获益,医学人员仍在不断研究,目前主要的评价指标有以下四个供临床医生参考:
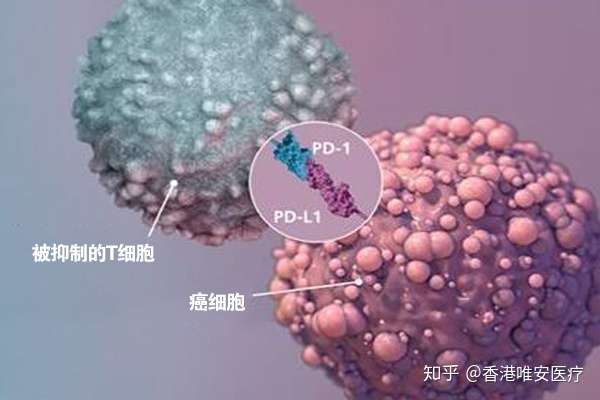
(1) PD-L1表达
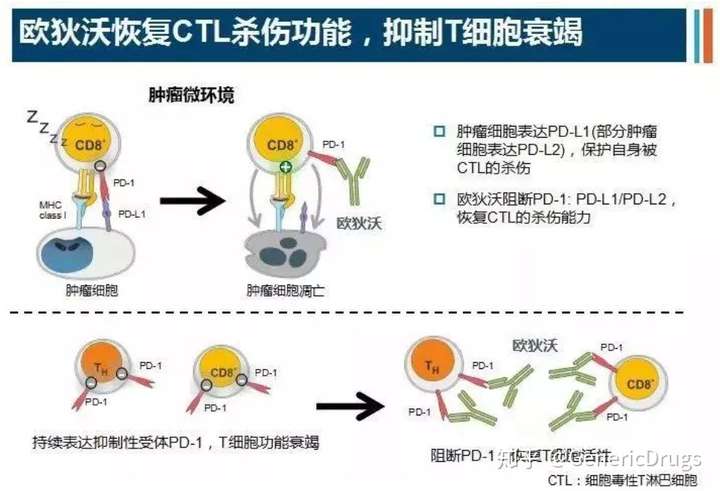
PD-1与PD-L1如同一对“情侣”,其中PD-1位于免疫细胞的表面,而PD-L1则位于肿瘤细胞的表面。这对“情侣”一旦结合,负责杀伤肿瘤细胞的免疫细胞就会把肿瘤细胞当作“朋友”,从而不再对其进行攻击。
研究发现,当肿瘤细胞表面有PD-L1的表达,那么使用PD-1抑制剂或者PD-L1抑制剂抑制肿瘤的概率就会增加,所以,肿瘤组织中PD-L1的表达情况,就成为预测PD-1/PD-L1抑制剂有效率的一个指标。在非小细胞肺癌的临床实验中,人们发现,如果肿瘤组织中PD-L1的表达率超过50%,PD-1抑制剂可以作为首选治疗方法治疗肿瘤,而如果PD-L1的表达率>1%,免疫检查点抑制剂可以使一线化疗失败的肺癌患者获益。
(2) MSI(微卫星)检测
微卫星不稳定性是我们身体中基因的一种病态情况,与肿瘤的发生密切相关。
研究表明,如果肿瘤组织中微卫星处于高度不稳定的状态,即MSI-H,使用PD-1抑制剂的有效率高于微卫星不稳定性低的状态(MSI-L)和微卫星稳定的状态(MSS)。所以,MSI-H就成为了预测PD-1抑制剂的一个重要的生物标志物。
(3) 肿瘤基因突变负荷(TMB)检测
肿瘤突变负荷高,从免疫治疗中获益的概率就大。在CheckMate-032临床研究中,按照TMB高低划分成TMB高、TMB中、TMB低三类病人,在接受联合治疗的人群中,三组的有效率分别为62%、20%、23%;而三组的中位总生存期,分别为:22.0个月、3.6个月、3.4个月——22.0个月与3.4个月,相差6倍!所以,TMB也是预测PD-1抑制剂的一个重要的生物标志物指标。
(4) 肿瘤浸润淋巴细胞(TIL)检测
通过免疫组化染色(CD3、CD4、CD8等),可以看出肿瘤组织中是否有较多的淋巴细胞浸润。浸润的淋巴细胞越多,PD-1抑制剂的有效率越高。
四、如果PD-1起效,到底应该用多久?
目前国内外,标准的方案是:手术或同步放化疗后,巩固性、辅助性使用的病友,PD-1抑制剂建议用满1年;而晚期的、全身转移的病友,建议用满2年。然而,越来越多的证据支持,使用PD-1抑制剂满6个月,且肿瘤缩小达到完全缓解、部分缓解(肿瘤缩小超过30%以上)的病友,可以再巩固2-3次后,酌情停药或调整剂量和间隔。
五、PD-1耐药后应该怎么办?
PD-1抑制剂有效的病人,一般疗效持久;但是,目前已经观察到30%左右的患者,出现了疾病的耐药。克服耐药的关键,主要是两点:
首选,如果可能,可以通过对新增的或者不断增大的耐药部位,进行穿刺活检和深入的免疫分析,找到耐药的原因,根据原因治疗。比如,有的病人是由于TIM-3、LAG-3或IDO代偿性高表达;那么选择,PD-1抑制剂联合TIM-3抑制剂、LAG-3抗体、IDO抑制剂,就是最好的治疗方案。
其次,对于不能明确耐药原因的病友,可以结合具体病情,选择最佳的联合搭档,逆转耐药,延长生存期;或者,更换为放化疗、介入、射频、粒子植入等传统治疗。
六、使用PD-1,患者需要注意哪些问题?
首先,如下病人不适合、不建议尝试PD-1抑制剂:病情进入终末期、卧床不起的病人;有急性细菌感染,尚未控制的病人;做过肝移植、肾移植的病人;有系统性红斑狼疮、白塞病、干燥综合征、血管炎等自身免疫病,尚未控制的病人;携带MDM2扩增、EGFR突变、JAK突变等病人等(有些患者可以首选靶向治疗)。
其次,使用PD-1抑制剂前,一般建议完善如下检查,基本正常,然后再使用:血常规、肝肾功、电解质、凝血、甲状腺功能,心电图、腹部B超、胸部X线。
最后,也是最重要的一点:越来越多的证据支持,PD-1抑制剂这类免疫治疗,应该在患者一般情况比较好,肿瘤负荷比较小的时候,尽早用。
七、PD-1和PD-L1究竟谁的抗癌效果更好?
说到PD-1,大家都不陌生,近两年,多个PD1扎堆国内上市,让大家几乎认为免疫治疗=PD1,但其实PDL1单抗近期也在不断的爆出数据,甚至更为亮眼。
与PD1类似,PD-L1可以阻断PDL1与T细胞表面的PD1结合介导的免疫抑制,重新激发T细胞识别杀伤肿瘤细胞,从而抑制肿瘤生长。与PD1单抗不同的是,它与肿瘤细胞或肿瘤浸润免疫细胞上表达的PDL1结合,而PD-1单抗与PD-1结合。

PD-L1单抗的优势是:
第一,只阻断PD-1~PD-L1通路,并不影响PD-1~PD-L2通路,避免间质性肺炎等副作用的发生。
第二,PD-1的临床研究显示,EGFR/ALK突变阳性的肺癌患者耐药后使用PD1获益更大,而PD-L1对EGFR/ALK阳性的PDL1表达≥25%的肺癌患者也能明显获益。
第三,PD-L1单抗除了可以抑制PD-1 – PD-L1通路外,还可以通过阻断B7.1和PD-L1的共抑制功能,有利于全面激活T细胞功能和细胞因子产生。因此,理论上PD-L1单抗可更全面激活免疫系统杀伤肿瘤,这也使得部分PD-1单抗治疗无效或耐药的患者,换用了PD-L1单抗后竟能神奇起效。
附:PD-1,PD-L1的前世/今生/未来
近几年在癌症领域一夜之间多了一种治疗方案,叫“PD(程序死亡性受体)-1/PD-L1免疫疗法”。
肿瘤免疫治疗是应用免疫学原理和方法,提高肿瘤细胞的免疫原性和对效应细胞杀伤的敏感性,激发和增强机体抗肿瘤免疫应答,协同机体免疫系统杀伤肿瘤、抑制肿瘤生长。
通俗一点
我们体内,癌细胞就像揭去封印的小恶魔,不再受人体的控制。一个变两个,两个变四个,四个变八个……癌细胞的特点就是失控性生长。
但是,人体免疫系统也不是白吃饭的。它就像是人体的铁甲卫士,专门负责截杀各路侵入人体的细菌、病毒等(比如细胞毒性T细胞,它是一种白细胞,能够侦查到被感染或发生突变的细胞)。当他发现这些细胞后就会发出毒素,启动其自毁程序(细胞程序性死亡)。
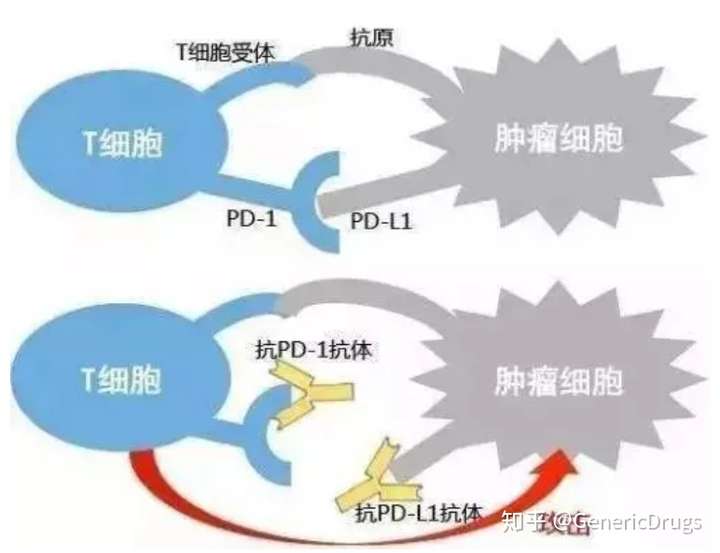
但T细胞这样玩命一路杀到底,杀红了眼,人挡杀人,佛挡杀佛,最后会把正常的健康细胞也杀死。所幸,激活一种名叫PD-1的分子,就可以关掉T细胞,使得正常细胞免受攻击。
也就是说,有了PD-1,T细胞就不会攻击正常细胞。但聪明的癌细胞也会表达PD-L1受体,和T细胞表面的PD-1结合,来迷惑T细胞。当PD-1和PD-L1结合之后,T细胞遇见肿瘤细胞就会手下留情,非但不会杀死肿瘤细胞,甚至让肿瘤细胞继续在人体内休养生息。
这该怎么办呢?
聪明的研究者们想到,只要阻止PD-1和PD-L1的结合就可以了。因此,他们研究出了分别跟这两个受体结合的抗体。
一种与T细胞表面的PD-1结合,使其重振往日雄风。另一种抗体与肿瘤细胞表面的PD-L1结合,让肿瘤细胞无法再迷惑T细胞。
最终,T细胞围剿各种肿瘤细胞,大获全胜。而这,就是我们常说的PD-1/PD-L1免疫疗法。
前世篇—CTLA-4
说到PD-1抑制剂,不得不提到CTLA-4抑制剂Yervoy®才是全球首个免疫检查点药物。
聊起CTLA-4抑制剂Yervoy®,可以说全是眼泪,如果当年BMS没有延缓CTLA-4的药物研发,或许PD-1抑制剂OPDIVO早10年就上市了。故事是这样说的:
法国人Pierre Goldstein在1987年无意中发现了T细胞上的一个分子CTLA-4,起初大家对这一分子并不在意,而纽约纪念斯隆凯特琳癌症中心的James Allison教授却敏锐地意识到CTLA-4可能在肿瘤免疫里具有“非同凡响”的功能。
James Allison算是开启了通过抑制免疫检查点的途径来治疗癌症的肿瘤免疫治疗新篇章。(所以Allison是癌症免疫治疗的先驱,估计很大可能会拿诺贝尔奖哟~)
BMS开始研究CTLA-4蛋白分子对抗癌症的影响,可惜后来他们发现这只是一点曙光而已,因为这个分子是在T细胞上,而其配体(ligand)并不具备肿瘤特异性,阻断CTLA-4会激活全身免疫系统,副作用太强。
这时候遗憾的事情发生了,BMS公司在投入免疫疗法研发方向近十年之后失去了耐心,因为看不到大的希望,于1997年决定将西雅图研发部门关掉。
某种程度上说,BMS公司当年对这一方向的不重视,某种程度上是拖延了免疫检查点药物的开发,否则这一类药物可能会早个10年问世。
不过好在2009年,BMS公司通过收购Medarex获得了ipilimumab。最终,美国FDA于2011年3月25日批准CTLA-4抑制剂ipilimumab(商标名称为Yervoy®)用于治疗晚期黑色素瘤。
今生篇—PD-1/PD-L1免疫疗法
除了CTLA-4以外,科学家陆陆续续发现了近十个免疫检查点,发现了真正具有肿瘤特异性的一个蛋白分子,也就是现在闻名天下的PD-1,从而掀起了验证通过抑制PD-1(或者PD-L1)是否能抗癌的研究新方向。
BMS公司研发的Opdivo最早于2014年7月在日本获得批准,是全球第一个获批上市的PD-1/PD-L1药物。2014年12月,Opdivo美国获批准上市。不得不说上帝还是眷顾BMS公司的。
说了这么辛酸史,肯定有人还是会问究竟PD-1/PD-L1究竟为什么会有这么大的魔力会激起科学家、医生和病友们如此大的兴趣呢?
持久性:对PD-1抑制剂有效的病人,疗效维持的平均时间较长,部分病友甚至维持了五年、十年。PD-1抑制剂的出现,让恶性黑色素瘤、肺癌、肾癌等多种肿瘤的生存时间明显延长,5年生存率甚至翻倍。对于那些使用PD-1抑制剂达到完全缓解、疗效维持时间超过5年的幸运儿,不少乐观的医生甚至认为这部分人已经被“临床治愈”,这是肿瘤医学史上,开天辟地、从未有过的。
广谱性:PD-1抑制剂,目前看来,对于绝大多数肿瘤,都是可以尝试的。目前临床试验以肿瘤突变负荷高,微卫星不稳定的肿瘤为主,包括黑色素瘤、肺鳞癌、肺腺癌、小细胞肺癌、胃肠道肿瘤、头颈癌、肝癌等。
低毒性:PD-1抑制剂毒副作用,相对于传统的放化疗等治疗要小的多,3~4级严重不良反应的发生率,降低了一半甚至更多。
现在我们再来扒一扒目前世界上,还有哪些PD-1/PD-L1已经上市:
Keytruda由默沙东公司开发,是美国FDA批准的第一个PD-1免疫检测点抑制剂。2015年,美国前总统卡特晚期黑色素瘤在Keytruda的作用下,神奇消失;在今年结束的美国临床肿瘤学会(ASCO)年会上,Keytruda更是展现了治疗多种癌症的潜力。
罗氏的Tecentrip(Atezolizumab)于2016年5月获批用于尿路上皮癌(膀胱癌),是全球第一个上市的PD-L1抑制剂。2016年10月被批准用于治疗靶向药、化疗失败的非小细胞肺癌患者。
2017年3月,美国FDA宣告同意由德国默克公司与辉瑞一起研制的免疫疗法新药Bavencio上市,用于治疗梅克尔细胞癌(MMC,一种稀有肿瘤), Bavencio成为全球第四个PD-1/PD-L1抗体药物
2017年5月,PD-1/PD-L1抑制剂竞技场迎来了第五名玩家,阿斯利康PD-L1单抗Imfinzi获得美国FDA加速批准,用于治疗晚期或转移性尿路上皮癌。
目前全球上市的5个 PD-1/PD-L1抑制剂均属于大分子抗体类药物。
未来篇
PD-1/PD-L1掀起了肿瘤治疗领域的新篇章。
随着科学家和医务工作者们对于肿瘤机理和药物治疗的不断改进和创新,新的PD-1/PD-L1也将会陆续诞生,并进一步提高肿瘤治疗的疗效和患者生存率以及生活质量。也许,在不远的未来,完全治愈肿瘤疾病将会从梦想变成现实!
对于我们中国的老百姓而言,得益于优先审批的绿色通道,Opdivo这款患者急需的PD-1在中国的审批一路畅通,于今年6月批准上市。而仅过了1个月,Keytruda也登陆中国,而且从递交到获批用时不到6个月,创下了中国进口抗肿瘤生物制剂最快审批记录。
就获批适应症情况来看,PD-1的使用仍较为受限,Opdivo获批的适应症仅为表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性局部晚期或转移性非小细胞肺癌(NSCLC)成人患。Keytruda目前的适应症为局部晚期或转移性黑色素瘤。除了以上提到的进口药以外,目前至少已经有17个国产的PD-1抑制剂(PD-1抗体、PD-L1抗体)进入临床试验或者即将进入临床试验,有望在1到两年内进入市场。
PD-1抑制剂以及其新的适应症会获批的越来越快,也会有更多的肿瘤患者能用得上这类好药。
放眼世界的历史长河,早在上世纪50年代,人们就掀起了肿瘤免疫学研究的热潮,2013年,《科学》杂志将免疫治疗列为年度十大科学突破之首,癌症治疗这也让免疫疗法再次成为全球研发的热点。目前除了PD-1抑制剂这一类的单克隆抗体以外,还有细胞治疗(比如最近大火的CAR-T疗法),肿瘤疫苗(如宫颈癌疫苗),小分子抑制剂,免疫系统调节剂等。
https://zhuanlan.zhihu.com/p/99503008


